1. Giới thiệu về số đăng ký thuốc
Trong ngành dược phẩm, số đăng ký thuốc đóng vai trò quan trọng trong việc quản lý, kiểm soát và lưu hành các loại thuốc trên thị trường. Đây là một mã số do cơ quan quản lý dược phẩm cấp cho từng loại thuốc, giúp xác định nguồn gốc, chất lượng và tính hợp pháp của sản phẩm. Bài viết này sẽ giúp bạn hiểu rõ hơn về khái niệm số đăng ký thuốc, quy trình cấp số đăng ký, cũng như tầm quan trọng của nó trong ngành dược phẩm.
2. Số đăng ký thuốc là gì?
Số đăng ký thuốc (Registration Number) là mã số được cấp bởi cơ quan quản lý dược phẩm của mỗi quốc gia, như Cục Quản lý Dược – Bộ Y tế Việt Nam. Mã số này giúp nhận diện và theo dõi từng loại thuốc lưu hành trên thị trường.

2.1. Ý nghĩa của số đăng ký thuốc
- Xác nhận thuốc đã được cấp phép lưu hành hợp pháp.
- Đảm bảo thuốc đạt tiêu chuẩn về chất lượng, an toàn và hiệu quả.
- Giúp người tiêu dùng dễ dàng tra cứu thông tin sản phẩm.
- Hỗ trợ các cơ quan quản lý trong việc kiểm soát và thu hồi sản phẩm nếu cần.
2.2. Định dạng số đăng ký thuốc
Ở Việt Nam, số đăng ký thuốc thường có dạng VN-XXXXX-YY, trong đó:
- VN: Ký hiệu thuốc sản xuất tại Việt Nam.
- XXXXX: Số thứ tự được cấp.
- YY: Hai chữ số cuối của năm cấp số đăng ký.
Ví dụ: VN-12345-23 là số đăng ký của một loại thuốc được cấp vào năm 2023.
3. Quy trình cấp số đăng ký thuốc
3.1. Điều kiện cấp số đăng ký thuốc
Để được cấp số đăng ký, thuốc cần đáp ứng các điều kiện sau:
- Có hồ sơ đăng ký đầy đủ theo quy định.
- Được sản xuất tại cơ sở đạt chuẩn GMP (Good Manufacturing Practice).
- Đạt các yêu cầu về an toàn, hiệu quả và chất lượng theo đánh giá của cơ quan quản lý.
- Có nhãn mác và hướng dẫn sử dụng rõ ràng, đúng quy định.
3.2. Các bước xin cấp số đăng ký thuốc
Bước 1: Chuẩn bị hồ sơ
- Phiếu đăng ký thuốc.
- Tài liệu nghiên cứu tiền lâm sàng và lâm sàng.
- Giấy chứng nhận thực hành tốt sản xuất thuốc (GMP).
- Hồ sơ chất lượng, thành phần và công thức bào chế.
Bước 2: Nộp hồ sơ Hồ sơ được nộp lên Cục Quản lý Dược – Bộ Y tế để xem xét và đánh giá.
Bước 3: Thẩm định hồ sơ Cơ quan chức năng sẽ thẩm định hồ sơ và có thể yêu cầu bổ sung nếu cần thiết.
Bước 4: Cấp số đăng ký Nếu thuốc đáp ứng đầy đủ tiêu chí, cơ quan quản lý sẽ cấp Giấy đăng ký lưu hành thuốc, trong đó có số đăng ký.
3.3. Thời hạn của số đăng ký thuốc
Số đăng ký thuốc thường có hiệu lực trong 5 năm. Sau thời gian này, nếu muốn tiếp tục lưu hành, doanh nghiệp phải làm thủ tục gia hạn số đăng ký.
4. Tầm quan trọng của số đăng ký thuốc
4.1. Đối với doanh nghiệp dược phẩm
- Giúp hợp pháp hóa sản phẩm trên thị trường.
- Tăng uy tín và độ tin cậy của thương hiệu.
- Hỗ trợ trong xuất khẩu thuốc sang thị trường quốc tế.
4.2. Đối với người tiêu dùng
- Đảm bảo thuốc được kiểm định và cấp phép.
- Tránh mua phải thuốc giả, thuốc kém chất lượng.
- Dễ dàng tra cứu thông tin sản phẩm trước khi sử dụng.
4.3. Đối với cơ quan quản lý
- Kiểm soát thị trường dược phẩm, ngăn chặn thuốc giả, thuốc không đạt chuẩn.
- Hỗ trợ việc thu hồi sản phẩm nhanh chóng khi cần.
5. Phân loại số đăng ký thuốc
Tại Việt Nam, số đăng ký thuốc được cấp cho nhiều loại thuốc khác nhau, bao gồm:
5.1. Thuốc sản xuất trong nước
- Được ký hiệu VN-XXXXX-YY.
- Thuốc phải đáp ứng tiêu chuẩn GMP – WHO.
5.2. Thuốc nhập khẩu
- Được ký hiệu QT-XXXXX-YY (QT = Quốc tế).
- Thuốc phải có Giấy phép lưu hành tại nước sản xuất (FSC – Free Sale Certificate).
5.3. Thuốc đông y, thuốc cổ truyền
- Phải có Giấy chứng nhận bài thuốc gia truyền.
- Đáp ứng tiêu chuẩn về thành phần, quy trình sản xuất.
5.4. Vắc xin và sinh phẩm y tế
- Được cấp số đăng ký riêng theo quy trình đặc biệt.
- Yêu cầu thử nghiệm lâm sàng chặt chẽ.
6. Hướng dẫn tra cứu số đăng ký thuốc
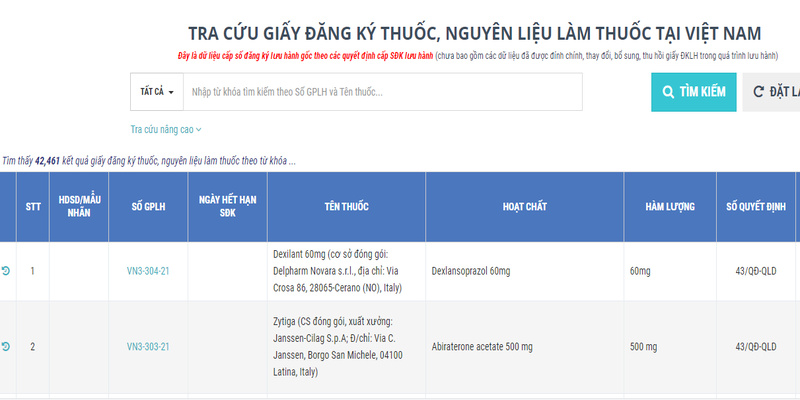
Người tiêu dùng có thể tra cứu số đăng ký thuốc trên Cổng thông tin của Cục Quản lý Dược:
Bước 1: Truy cập https://dichvucong.dav.gov.vn
Bước 2: Nhập số đăng ký hoặc tên thuốc vào ô tìm kiếm.
Bước 3: Kiểm tra thông tin chi tiết về thuốc, nhà sản xuất, hạn dùng số đăng ký.
7. Câu hỏi thường gặp về số đăng ký thuốc
7.1. Nếu thuốc không có số đăng ký có được phép bán không?
Không. Thuốc không có số đăng ký hoặc đã hết hạn số đăng ký sẽ không được phép lưu hành.
7.2. Có thể xin cấp số đăng ký nhanh không?
Có, trong một số trường hợp đặc biệt như dịch bệnh, thiên tai, thuốc có thể được cấp phép nhanh theo quy trình rút gọn.
7.3. Thuốc nhập khẩu có cần số đăng ký tại Việt Nam không?
Có, tất cả thuốc nhập khẩu đều phải đăng ký tại Cục Quản lý Dược Việt Nam trước khi lưu hành.
8. Kết luận
Số đăng ký thuốc là yếu tố quan trọng trong ngành dược phẩm, đảm bảo tính pháp lý, chất lượng và an toàn của thuốc trước khi đến tay người tiêu dùng. Việc hiểu rõ về số đăng ký thuốc sẽ giúp các doanh nghiệp, cơ sở y tế và người tiêu dùng sử dụng thuốc an toàn và hiệu quả hơn.
Nếu bạn muốn tìm hiểu thêm về quy trình đăng ký thuốc hoặc các thông tin liên quan đến dược phẩm, có thể tham khảo tại:
- Trang web chính thức: https://devfest.vn/
- Mua bán nhà tại Bình Dương giá 300 triệu: https://devfest.vn/mua-ban-nha-tai-binh-duong-gia-300-trieu/
